Enhertu при раке легкого: Где он одобрен и как его получить?
Последнее обновление: 15 июля 2024 г.
Вы можете легально получить доступ к новым лекарствам, даже если они не одобрены в вашей стране.
Узнайте, какEnhertu (fam-trastuzumab deruxtecan-nxki) стал одним из наиболее популярных методов лечения рака с момента его первого одобрения FDA в 2019 году 1.
Поскольку безопасность и эффективность Enhertu при раке яичников и колоректальном раке еще изучаются, препарат уже одобрен для применения по нескольким показаниям. В том числе HER2-позитивный рак молочной железы, HER2-позитивный рак желудка и HER2-низкий рак молочной железы. FDA также одобрило препарат Enhertu для лечения HER2-мутантного немелкоклеточного рака легкого. Европейская комиссия CHMP недавно дала положительное заключение на проведение аналогичных исследований в странах ЕС 2.
Если вы являетесь пациентом с раком легкого в Великобритании или в других странах за пределами США и ЕС, вас, вероятно, интересует, когда Enhertu станет доступен и для вас.
Вот все, что нужно знать об Enhertu при раке легкого, и о том, чего могут ожидать пациенты в Великобритании и других странах мира.
Каковы показания к применению сайта Enhertu при раке легкого?
Являясь таргетной терапией, Enhertu предназначен только для лечения рака с мутацией HER2. Таким образом, лечение применяется примерно к 2% всех пациентов с НСКЛ 3.
Enhertu Показан в качестве монотерапии взрослым пациентам с распространенным НСКЛ, опухоли которых имеют активирующую мутацию HER2 (ERBB2). Enhertu предназначен для пациентов, получивших предшествующую системную терапию, у которых рак либо распространился на другие части тела, либо не может быть удален хирургическим путем 2.
Каков процент успеха Enhertu при раке легкого?
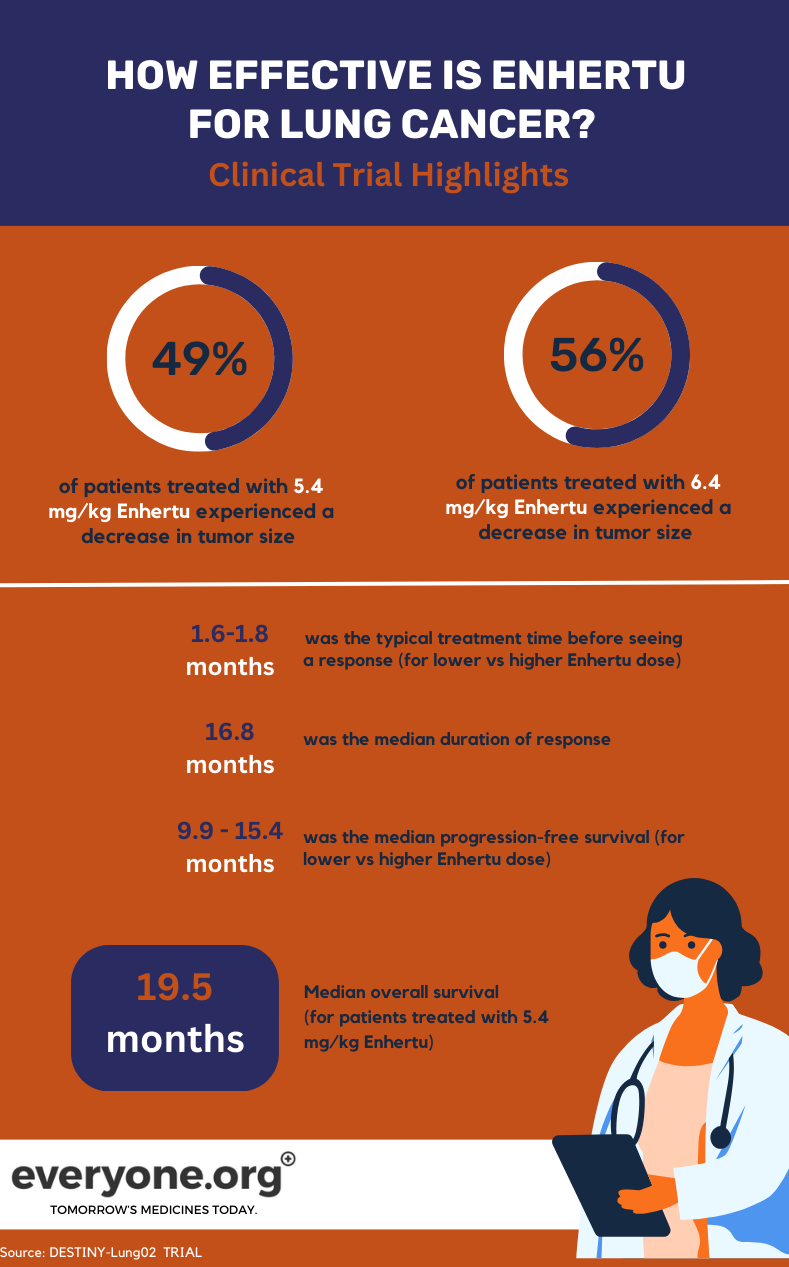
Проводимое исследование DESTINY-Lung02 фазы II изучает безопасность и эффективность Enhertu в лечении HER2-мутированного НСКЛ. В исследовании сравниваются две дозы препарата Enhertu (5,4 мг/кг и 6,4 мг/кг).
Для больных раком легкого основными предварительными результатами исследования DESTINY-Lung02 являются:
- Опухоли уменьшились у 49% пациентов, получавших меньшую дозу Enhertu , и у 56% пациентов, получавших большую дозу.
- Опухоли полностью исчезли у 1% и 4% пациентов в группе с меньшей и большей дозой, соответственно.
- Медиана продолжительности ответа составила 16,8 месяцев для пациентов в группе с меньшей дозой Enhertu . Для пациентов в другой группе продолжительность ответа была оценена как не поддающаяся оценке.
- Медиана времени, необходимого для наблюдения первоначального ответа на лечение, составила 1,8 и 1,6 месяца в группе с меньшей и большей дозой соответственно.
- Медиана беспрогрессивной выживаемости составила 9,9 месяца при дозе 5,4 мг/кг и 15,4 месяца при дозе 6,4 мг/кг 4.
Какова медиана выживаемости для пациентов сайта Enhertu ?
Для пациентов, получавших в клиническом исследовании меньшую дозу Enhertu , медиана общей выживаемости (OS) составила 19,5 месяцев. Для группы 4, получавшей более высокую дозу препарата, показатель OS был признан не поддающимся оценке.
Каковы побочные эффекты Enhertu на легкие?
Сообщалось о некоторых тяжелых, угрожающих жизни или смертельных случаях интерстициальной болезни легких (ИБЛ) у пациентов с Enhertu . Пациенты с умеренной почечной недостаточностью могут подвергаться более высокому риску 6.
В исследовании DESTINY-Lung02 ОЛЛ отмечалась у 12,9% пациентов в группе низких доз и у 28% пациентов в группе высоких доз. Большинство этих случаев не были тяжелыми. ОЛЛ 3-й степени и выше была зарегистрирована у 2% пациентов в обеих группах.
EnhertuПрофиль безопасности препарата при раке легкого сходен с его показателями при других показаниях. На основании меньшей частоты побочных эффектов (38,6% против 58%) доза 5,4 мг/кг считается оптимальной для лечения больных НСКЛ 4.

Где находится сайт Enhertu , одобренный для лечения рака легкого?
В настоящее время препарат Enhertu одобрен в США, ЕС, Израиле и Японии для лечения взрослых пациентов с нерезектабельным или метастатическим НСКЛК, опухоли которых имеют активирующие мутации HER2 (ERBB2) 4.
Одобрен ли сайт Enhertu для лечения рака легкого в Великобритании?
По состоянию на июль 2024 года - еще нет. В окончательном проекте руководства, опубликованном NICE в марте 2024 года, сообщается, что Enhertu не будет доступен в NHS до тех пор, пока не появится экономически эффективная цена. Тем временем, к сожалению, Enhertu не доступен в Великобритании для лечения рака легких 7.
Может ли мой врач назначить Enhertu для лечения рака легкого, если этот препарат еще не одобрен?
Короткий ответ - да.
Enhertu уже одобрен во многих странах для лечения НСКЛ с мутацией HER2. Исходя из этого, ваш врач имеет право назначить препарат по данному показанию, даже если он еще не одобрен в вашей стране.
Когда врач выписывает рецепт на лекарство для лечения заболевания, для которого оно еще не одобрено (пока), это называется использованием не по назначению. В некоторых странах, в зависимости от местного законодательства и доступности лекарств, рецепт, выписанный не по назначению, может быть трудновыполним. Однако его всегда можно выписать, используя правила импорта по имени пациента.
Ваш врач принял решение о назначении препарата Enhertu для лечения рака легких? Наша команда на сайте www.everyone.org может помочь вам получить доступ к этому лекарству. Мы специализируемся на поиске и доставке лекарств, не одобренных или недоступных в стране пациента. Свяжитесь с нами, и мы сможем вам помочь.
Ссылки:
- Стюарт, Джудит. Enhertu (fam-trastuzumab deruxtecan-nxki) История одобрения FDA. Drugs.com, 15 августа 2022 г.
- Enhertu. European Medicines Agency, Accessed 06 November 2023.
- HER2 и рак легкого. American Lung Association, Accessed 6 November 2023.
- Enhertu продемонстрировала сильную и стойкую реакцию опухоли при ранее леченном HER2-мутантном распространенном раке легкого в ходе исследования DESTINY-Lung02 фазы II. АстраЗенека, 11 сентября 2023 г.
- Информация о проекте | Трастузумаб дерукстекан для лечения HER2-мутированного нерезектабельного или метастатического несквамозного немелкоклеточного рака легкого после 1 или более терапий [ID3934] | Guidance. NICE, Доступно 6 ноября 2023 г.
- USPI-DB-04 CDX Update FINAL. Daiichi Sankyo, Accessed 6 November 2023.
- Британский NICE отклонил Daiichi Sankyo' Enhertu для лечения рака молочной железы, Фармацевтические технологии, Доступно 15 июля 2024 г.