Может ли Enhertu лечить колоректальный рак? Последние результаты, сроки утверждения и многое другое.
Последнее обновление: 15 июля 2024 г.
Вы можете легально получить доступ к новым лекарствам, даже если они не одобрены в вашей стране.
Узнайте, какС момента своего первого одобрения FDA в 2019 г, Enhertu привлек к себе большое внимание в мире онкологии. В 2023 году Enhertu продолжает свою впечатляющую траекторию, получив еще два разрешения FDA на прорыв. В настоящее время он может похвастаться в общей сложности семью 1.
Одно из последних достижений Enhertu- одобрение препарата в качестве средства диагностики рака. Это означает, что теперь он может применяться для всех пациентов с HER2-экспрессирующими опухолями, включая колоректальную опухоль. Для всех пациентов с колоректальным раком это важная веха. В то же время оно ставит множество вопросов.
Вот все, что нужно знать об Enhertu при колоректальном раке.
Имеет ли сайт Enhertu одобрение FDA для лечения колоректального рака?
Да. В апреле 2024 года сайт Enhertu будет одобрен для использования при всех видах рака, где присутствует экспрессия HER2. Сюда также входит колоректальный рак.
Для каких типов рака одобрен Enhertu ?
Enhertu В настоящее время одобрен EMA в Европе для лечения:
- HER2-положительный метастатический рак молочной железы, который не может быть удален хирургическим путем;
- Метастатический рак молочной железы с низким уровнем HER2, который не может быть удален хирургическим путем;
- HER2-положительный распространенный рак желудка (рак желудка) или рак желудочно-пищеводного перехода 4.
В США Enhertu дополнительно одобрен для лечения:
- HER2-мутантный метастатический немелкоклеточный рак легкого 5.
- все HER2-экспрессирующие солидные опухоли.
Насколько эффективен сайт Enhertu при колоректальном раке?
Поскольку Enhertu является таргетной терапией, она применима только к раковым опухолям с экспрессией HER-2. Под эту категорию попадает около 3-5% всех колоректальных раков 6.
Результаты клинических испытаний
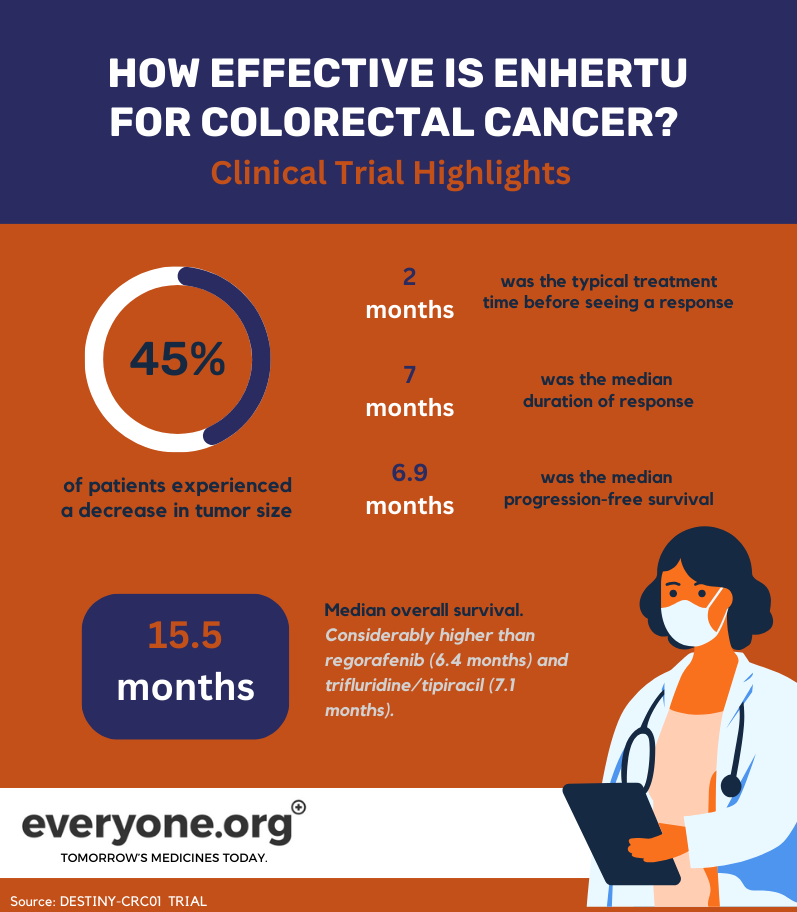
В июне 2023 года были опубликованы окончательные результаты исследования DESTINY-CRC01. Это исследование 2-й фазы было направлено на оценку эффективности и безопасности препарата Enhertu у пациентов с HER2-экспрессирующим метастатическим колоректальным раком. Пациенты, участвовавшие в исследовании, имели опухоли, прогрессировавшие после как минимум 2 предшествующих раундов лечения 7.
Основными результатами этого исследования для больных колоректальным раком были:
-
У 45,3% пациентов, получавших Enhertu , наблюдалось частичное уменьшение опухоли;
-
Ответ на лечение обычно наблюдался примерно через 2 месяца после начала лечения;
-
Медиана продолжительности ответа составила 7 месяцев;
-
Медиана беспрогрессивной выживаемости составила 6,9 месяца;
-
Медиана общей выживаемости составила 15,5 месяцев. Этот результат значительно превосходит существующие стандарты лечения. Например, regorafenib и trifluridine/tipiracil являются распространенными методами терапии третьей линии. Общая выживаемость при этих методах лечения составляет 6,4 месяца и 7,1 месяца, соответственно 7.
В другом исследовании, получившем название DESTINY-CTC02, изучается препарат Enhertu для лечения больных колоректальным раком. Это исследование еще продолжается, но его предварительные результаты соответствуют результатам исследования DESTINY-CTC01 10.

Насколько безопасен сайт Enhertu при колоректальном раке?
Что касается безопасности, то таковы основные результаты исследования DESTINY-CRC01:
-
У каждого пациента наблюдались побочные эффекты от лечения. Наиболее распространенными побочными эффектами были проблемы с желудком и кровью.
-
Серьезные побочные эффекты возникли у 37,7% пациентов. Наиболее частыми серьезными побочными эффектами были низкое количество нейтрофилов (22,1%) и анемия (14%) 7.
-
Побочный эффект, называемый интерстициальной болезнью легких (ИБЛ), был связан с прекращением приема препарата и наблюдался у 7% пациентов.
-
Было зарегистрировано 3 случая смерти, связанных с приемом препарата, все они были связаны с интерстициальным заболеванием легких.
Что это означает?
EnhertuРезультаты безопасности препарата нельзя напрямую сравнивать между различными группами пациентов. Тем не менее, чтобы помочь вам понять ситуацию, ниже приведены результаты безопасности Enhertu по различным типам опухолей. Включая опухоли, для которых Enhertu уже одобрен:
-
ОЛЛ возникла у 12% пациентов, участвовавших в исследовании, с летальным исходом в 1,5% случаев;
-
Снижение количества нейтрофилов наблюдалось у 34,6% пациентов, участвовавших в исследовании;
-
Анемия наблюдалась у 34-43% пациентов исследования (в зависимости от дозы препарата) 8.
Учитывая это, профиль безопасности Enhertu при колоректальном раке аналогичен профилю безопасности при других разрешенных видах рака.
Когда будет одобрен Enhertu для лечения колоректального рака?
Enhertu Уже одобрен FDA для лечения HER2-положительного колоректального рака - показание, которое подпадает под последнее одобрение FDA Enhertu.
Однако это последнее одобрение является фактом только в США. Что это означает для пациентов с колоректальным раком в других странах? Какую роль может сыграть сайт Enhertu в лечении вашего рака толстой кишки?
Может ли мой врач назначить Enhertu для лечения колоректального рака?
Короткий ответ - да.
Enhertu уже одобрен FDA для лечения HER2-положительного колоректального рака. Даже если вы находитесь в другой стране, ваш врач в любом случае имеет право назначить препарат по этому показанию. Он может сделать это на основании окончательных результатов исследования DESTINY-CRC01 или предварительных результатов исследования DESTINY-CRC02, а также с учетом специфики вашего случая.
Если врач выписывает вам лекарство для лечения заболевания, для которого оно не одобрено на местном уровне, это и есть off-label use. В некоторых странах заполнение рецепта, выписанного не по назначению, может быть затруднено из-за местных правил и доступности. Однако его всегда можно заполнить, используя правила импорта по имени пациента.
Ваш врач принял решение о назначении препарата Enhertu для лечения колоректального рака? Наша команда на сайте www.everyone.org может помочь вам получить доступ к этому лекарству. Мы специализируемся на поиске и доставке лекарств, не одобренных или недоступных в стране пациента. Свяжитесь с нами, и мы сможем вам помочь.
Ссылки:
- Барри, Роберт. Enhertu получил два сертификата FDA на прорывную терапию. Фармацевтические технологии, 31 августа 2023 г.
- Управление по контролю качества пищевых продуктов и лекарственных препаратов США (FDA) присвоило статус "терапии прорыва" препарату трастузумаб дерукстекан для лечения HER2+ солидных опухолей, включая мПКР. OncLive, 31 августа 2023 г.
- Прорывная терапия. FDA, 4 января 2018 г.
- Enhertu | Европейское агентство по лекарственным средствам. European Medicines Agency, Accessed 30 October 2023.
- Стюарт, Джудит. Enhertu (fam-trastuzumab deruxtecan-nxki) История одобрения FDA. Drugs.com, 15 августа 2022 г.
- Биомаркер HER2 при раке толстой кишки. Знай свой биомаркер, 24 мая 2023 г.
- Окончательные результаты исследования DESTINY-CRC01 по изучению трастузумаба и дерукстекана у пациентов с HER2-экспрессирующим метастатическим колоректальным раком. Nature Communications, Accessed 30 October 2023.
- Enhertu, МНН-трастузумаб дерукстекан. European Medicines Agency , Accessed 30 October 2023.
- Трастузумаб Дерукстекан у участников с HER2-экспрессирующим распространенным или метастатическим колоректальным раком (DESTINY-CRC02). ClinicalTrials.gov, Accessed 30 October 2023.
- Трастузумаб дерукстекан (T-DXd) у пациентов (pts) с HER2-overexpressing/amplified (HER2+) метастатическим колоректальным раком (МКРР): Первичные результаты многоцентрового рандомизированного исследования 2-й фазы DESTINY-CRC02. Journal of Clinical Oncology, Accessed 30 October 2023.