Все, что нужно знать пациентам об Aduhelm (адуканумабе) | Новая медицина Альцгеймера
Последнее обновление: 15 марта 2022 г.

Вы можете легально получить доступ к новым лекарствам, даже если они не одобрены в вашей стране.
Узнайте, какСтатья рецензирована доктором Яном де Виттом
7 июня 2021 года FDA одобрило препарат адуканумаб (выпускаемый под торговым названием "Aduhelm") для лечения болезни Альцгеймера, что вызвало надежды миллионов пациентов с болезнью Альцгеймера и членов их семей по всему миру, в то время как эксперты выразили свою обеспокоенность этим решением.
Aduhelm - первое лекарство от болезни Альцгеймера, одобренное FDA за последние 18 лет. Согласно опубликованным результатам, препарат способен замедлить прогрессирование самой болезни Альцгеймера, а не облегчить ее симптомы.
Решение Управления по контролю за продуктами и лекарствами США (FDA) об одобрении препарата было сопряжено со множеством споров. Тем не менее компания Biogen, производитель препарата Aduhelm, рассчитывает начать поставки Aduhelm в более чем 900 медицинских центров в США к концу июня 2021 года.
В настоящее время препарат Aduhelm доступен для подходящих пациентов за пределами Соединенных Штатов по принципу "сострадания" или "для определенных пациентов". Узнайте больше, перейдя к разделу "Доступ к Aduhelm за пределами Соединенных Штатов".
Болезнь Альцгеймера: один из главных социальных, медицинских и экономических кризисов XXI века
Болезнь Альцгеймера - это дегенеративное заболевание головного мозга, которое сегодня поражает более 40 миллионов человек во всем мире и является наиболее распространенной причиной деменции. В течение многих лет болезнь Альцгеймера считалась нормальным процессом старения, но сегодня она признана заболеванием, имеющим серьезные последствия для здравоохранения, экономики и общества.
Исследователи пока не до конца понимают, что вызывает болезнь Альцгеймера, но считается, что она обусловлена сочетанием таких факторов, как:
- Старение: Болезнь Альцгеймера чаще всего диагностируется в возрасте после 65 лет (поздняя болезнь Альцгеймера). Около трети людей в возрасте 85 лет и старше страдают болезнью Альцгеймера. Изменения в мозге, связанные со старением, могут способствовать развитию заболевания.
- Семейный анамнез: Наличие родственников первой степени родства с болезнью Альцгеймера повышает риск развития заболевания у человека. Ученые считают, что генетическая предрасположенность может вызывать раннюю форму болезни Альцгеймера, которая возникает у людей в возрасте от 30 до 60 лет. Только у 10 % пациентов с болезнью Альцгеймера наблюдается ранняя форма заболевания.
- Другие факторы: Ученые обнаружили связь между снижением когнитивных способностей и болезнями сердца, а также диабетом и ожирением. Самые убедительные доказательства связывают здоровье мозга со здоровьем сердца. Травмы головы также связаны с повышенным риском развития болезни Альцгеймера, поскольку они могут провоцировать образование амилоидных бляшек. Люди с синдромом Дауна, при котором лишняя хромосома определяет генетическое кодирование одного из видов амилоидного белка, связанного с болезнью Альцгеймера, также подвержены повышенному риску.
Большинство людей с болезнью Альцгеймера диагностируются на легкой стадии, когда симптомы становятся более выраженными и болезнь уже вызвала некоторые повреждения мозга, несмотря на то, что некоторые симптомы начинают проявляться еще за десятилетие до постановки диагноза. Ранние симптомы могут игнорироваться пациентами (часто из-за стыда) или просто не замечаться врачами или членами семьи. Средняя продолжительность жизни пациентов после постановки диагноза составляет 3-11 лет.
"Со временем мама забыла, кто я такой".
Болезнь Альцгеймера имеет три различные стадии:
- Легкая: На первых стадиях пациенты испытывают такие проблемы с памятью, как забывание важных дат и событий, частое повторение вопросов, увеличение времени на выполнение повседневных задач, постоянные проблемы с финансами, частые перестановки предметов и беспокойство. (Чтобы узнать больше о том, насколько потеря памяти является нормальным явлением при старении, ознакомьтесь с инфографикой Национального института здоровья (NIH) по проблемам старения).
- Умеренная: По мере прогрессирования заболевания у пациентов усиливается потеря памяти и спутанность сознания, возникают трудности с общением и чтением, трудности с выполнением рутинных задач, таких как одевание, проблемы с узнаванием родных и друзей, паранойя, галлюцинации и блуждание.
- Тяжелая: Пациенты с тяжелой формой болезни Альцгеймера не могут общаться, теряют вес, испытывают трудности с глотанием, теряют контроль над кишечником и мочевым пузырем. На этой стадии пациенты большую часть времени находятся в постели и полностью зависят от окружающих.
Пациенты с болезнью Альцгеймера испытывают огромные трудности, ведь болезнь влияет на все аспекты их повседневной жизни. Ниже вы можете прочитать несколько историй, рассказанных самими пациентами или их друзьями и родственниками.
Сэнди, бывший стоматолог и доцент Гарварда, рассказал журналистам CNN о том, как осознал, что его забывчивость перешла в нечто худшее: "Я полтора часа изучал историю болезни стоматолога, - вспоминает он. Я читаю ее, она у меня в мозгу. Потом я закрывал папку и не помнил буквально ничего о деле". Вскоре после этого у него диагностировали болезнь Альцгеймера.
Фред Уокер, у жены которого была диагностирована болезнь Альцгеймера, рассказал о своей жене в интервью Alzheimer's Research UK: "Пользоваться телефоном стало выше ее возможностей. Она не могла освоить все кнопки. Плита была слишком сложной для понимания, и всегда существовала опасность, что она оставит газ включенным. Приготовление чашки чая стало для нее слишком сложной задачей, и она путалась в том, сколько нужно чая, молока и воды".
Болезнь Альцгеймера, достигающая поздних стадий и переходящая в деменцию, описана Лаури для Общества Альцгеймера:
"[...] Мы отправились в новое путешествие. Оно включало в себя круглосуточный уход, ежедневный прием лекарств и то, что мама совершенно потерялась в тумане собственного разума. [...] До этого момента мы не осознавали, насколько ужасно наблюдать за близким человеком с этой жестокой, коварной болезнью. [...] У нее начались галлюцинации".
Основатель everyone.org Сьяк Винк подтверждает и признает каждое из этих описаний. В 2015 году его матери был поставлен диагноз "болезнь Альцгеймера".
Это трудный путь для пациентов и их близких - и болезнь не ограничивается тем, что влияет только на их личную жизнь и жизнь их близких.
Давление на сиделок, бюджеты и политиков
По мере ухудшения состояния пациентам с болезнью Альцгеймера требуется все более сложный уход, например, уход на дому, ночной уход, услуги домработницы или сиделки; в конечном итоге пациенты могут нуждаться в проживании в домах престарелых или домах престарелых. Болезнь ложится тяжелым бременем на пациента, членов его семьи (которые часто посвящают себя уходу за больным), а также на личный бюджет и бюджет государства.
Семейные сиделки сталкиваются с трудной миссией, ухаживая за своими близкими с болезнью Альцгеймера. Исследование показало, что 95 % семейных сиделок в Великобритании говорят, что это влияет на их физическое или психическое здоровье, 69 % сообщают, что чувствуют постоянную усталость, 64 % испытывают тревогу и 49 % - депрессию.
В Европе болезнью Альцгеймера и другими формами деменции страдают около 10 миллионов человек, и ожидается, что к 2030 году их число возрастет до 14 миллионов. По оценкам, экономические затраты на деменцию в Европе к 2030 году составят более 250 миллиардов евро, причем более 50 % из них приходятся на неформальный уход. Существует неравный доступ к уходу и лечению, и, особенно в Восточной Европе, не хватает систем поддержки и социальных программ для пациентов с болезнью Альцгеймера и их сиделок.
В Соединенных Штатах болезнь Альцгеймера недавно вошла в список 10 самых распространенных причин смерти и является единственным заболеванием в этой десятке, от которого не существует лечения. От нее страдают 6 миллионов человек в США, и по прогнозам к 2050 году их число возрастет до 12 миллионов. К концу 2021 года общие национальные расходы на уход за людьми, живущими с болезнью Альцгеймера и другими деменциями, могут составить 355 миллиардов долларов, а к 2050 году, по прогнозам, достигнут 1,1 триллиона долларов.
Это финансирование, каким бы астрономическим оно ни казалось, необходимо для того, чтобы обеспечить пациентам адекватную поддержку и, насколько это возможно, достойную жизнь.
Из-за необходимости круглосуточного ухода, особенно на поздних стадиях, пациенты с болезнью Альцгеймера особенно страдают, если уход за ними неадекватен, что наблюдается во многих странах и сообществах. Только в Великобритании десятки тысяч людей с деменцией ежегодно попадают в отделение неотложной помощи из-за инфекций, падений и обезвоживания, вызванных недостаточным уходом. Это еще больше увеличивает нагрузку на национальные бюджеты здравоохранения.
Во время пандемии COVID-19 пациенты с болезнью Альцгеймера сильно пострадали и понесли большое количество смертей из-за возраста, других долгосрочных заболеваний и самих проблем с болезнью Альцгеймера (например, проблемы с памятью и спутанность сознания, из-за которых пациенты с трудом выполняют рекомендации по предотвращению заражения COVID-19).
Пациенты с болезнью Альцгеймера, находящиеся в домах престарелых, ощущают пагубные последствия и в других отношениях. Из-за недостаточного ухода и вынужденной разлуки с близкими, чтобы обезопасить их от COVID-19, одиночество и изоляция еще больше ухудшили их психическое и физическое здоровье.
Чтобы не допустить серьезных последствий для здоровья и экономики, необходимы эффективные методы лечения этого заболевания.
Основные направления исследований болезни Альцгеймера
В 1910 году Эмиль Крепелин, врач из Германии, назвал это заболевание "болезнью Альцгеймера" в честь врача Алоиза Альцгеймера, который обнаружил патологические признаки пресенильной деменции у пациента с глубокой потерей памяти и ухудшающимися психологическими изменениями. Исследования в области лечения болезни Альцгеймера начались только в конце 1980-х годов в США, но столкнулись с критикой, поскольку врачи по-прежнему считали, что болезнь Альцгеймера является неизбежным следствием старения.
В США в 1978 году Национальный институт старения (NIA) и Ассоциация Альцгеймера в партнерстве с компанией Pfizer начали первые клинические испытания лекарства, которое должно было лечить симптомы болезни Альцгеймера. Лекарство было одобрено в 1993 году: Cognex (такрин), согласно опубликованным результатам, улучшал когнитивные способности у некоторых пациентов, но не останавливал усугубление болезни.
В течение следующего десятилетия были одобрены еще шесть лекарств, все для лечения когнитивных симптомов болезни Альцгеймера:
- Арисепт (донепезил): для лечения симптомов, связанных с памятью и мышлением
- Разадин (галантамин): для лечения симптомов, связанных с памятью и мышлением
- Экселон (ривастигмин): для лечения симптомов, связанных с памятью и мышлением
- Наменда (мемантин): улучшает память, внимание, мышление, язык
- Намзарик (мемантин + донепезил): комбинация вышеперечисленных препаратов
- Белсомра (суворексант): для лечения бессонницы у пациентов с болезнью Альцгеймера
Последнее лекарство, одобренное для лечения болезни Альцгеймера, было утверждено в 2003 году. В течение десятилетий болезнь Альцгеймера считалась естественным следствием старения. На поиск лечения выделялось мало средств, поскольку велись споры о том, является ли она настоящим заболеванием. Однако за последние 20 лет исследователи направили огромные ресурсы на изучение болезни и разработку лечения.
Отсутствие методов лечения болезни Альцгеймера не связано с пренебрежением со стороны фармацевтических компаний - отрасль в целом вкладывает миллиарды в исследования. Только компания Eli Lilly за три десятилетия потратила 4,2 миллиарда долларов на разработку успешного лекарства, а Национальные институты здравоохранения США (NIH) ежегодно тратят более 500 миллионов долларов на исследования и разработку методов лечения.
С 2013 года Конгресс США утроил годовой бюджет NIH на финансирование исследований болезни Альцгеймера и связанных с ней деменций, доведя его до 3,1 миллиарда долларов в 2019 году.
Благодаря государственному и частному финансированию к 2019 году было проведено 2173 клинических испытания, в ходе которых проверялись различные теории. Основные проверенные теории:
- 19% исследований были посвящены гипотезе о нейротрансмиттерах
- В 17,0% исследований проверялась гипотеза митохондриального каскада и другие связанные с ней гипотезы
- 12,7% проверили гипотезу о распространении тау
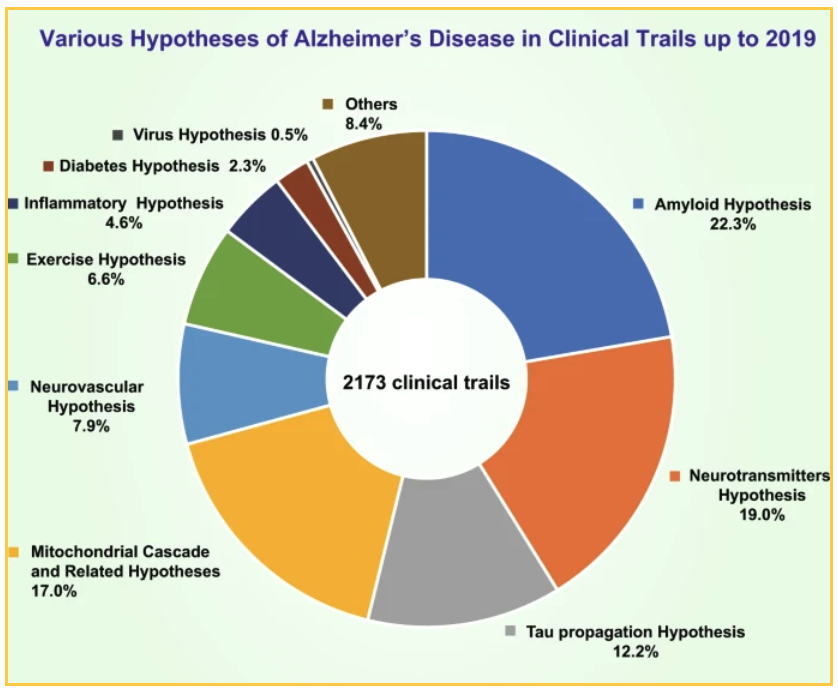
22,3% исследований, направленных на борьбу с амилоидом, посвящены различным способам уменьшения бляшек:
- Антитела к бета-амилоиду, вырабатываемые иммунной системой: "Активные вакцины", которые при введении в организм запускают иммунную систему на выработку антител, уничтожающих бета-амилоид и снижающих его уровень в мозге.
- Выработанные в лаборатории антитела к бета-амилоиду: "Пассивные вакцины", которые считаются более эффективными и безопасными, чем попытки вызвать выработку антител в организме.
- Снижение выработки бета-амилоида: Некоторые экспериментальные методы лечения изменяют поведение определенных белков, что может предотвратить или уменьшить выработку бета-амилоида.
- Предотвращение агрегации бета-амилоида: Ученые исследуют препараты, предотвращающие начальные взаимодействия между бета-амилоидом и клетками мозга, которые приводят к гибели клетки мозга.
- Увеличение выведения бета-амилоида: Такие методы, как мобилизация иммунной системы для атаки бета-амилоида или введение натуральных агентов с антиамилоидным эффектом.
- Природные агенты с антиамилоидным действием: Внутривенный иммуноглобулин (IVIg), полученный из донорской крови, содержит природные антитела, способные снижать уровень бета-амилоида.
Что такое Aduhelm aducanumab-avwa)?
Aduhelm (адуканумаб) - это антиамилоидное антитело, предназначенное для лечения болезни Альцгеймера. Он предназначен для удаления бета-амилоидных бляшек, которые образуются между клетками мозга в аномальных количествах у пациентов с болезнью Альцгеймера, что приводит к гибели пораженных клеток мозга. Бета-амилоид был идентифицирован в 1984 году и быстро был признан основным триггером повреждения клеток мозга, а в 1986 году был идентифицирован белок тау, ключевой компонент клубков и второй триггер разрушения клеток мозга.
Препарат Aduhelm был разработан компанией Biogen, Inc., многонациональной биотехнологической компанией, расположенной в штате Массачусетс, США. Aduhelm назначается в виде ежемесячных инъекций.
У Aduhelm долгая история.
Швейцарская биотехнологическая компания Neurimmune Therapeutics AG в сотрудничестве с Цюрихским университетом выявила защитные антиамилоидные антитела у здоровых пожилых людей и пациентов с медленно прогрессирующей деменцией, что привело к открытию адуканумаба, активного ингредиента препарата Aduhelm. У пациентов с легкой формой болезни Альцгеймера в течение одного года ежемесячных внутривенных инфузий адуканумаба уменьшается количество амилоидных бляшек, что приводит к замедлению снижения когнитивных способностей.
Компания Neurimmune лицензировала препарат адуканумаб для лечения болезни Альцгеймера у компании Biogen в 2007 году и сотрудничает с Biogen в области его разработки.
Как работает Aduhelm ?
Болезнь Альцгеймера, по-видимому, является результатом необычного накопления в мозге двух белков - бета-амилоида и тау. Бета-амилоид - это белок, который в норме присутствует в мозге, но при болезни Альцгеймера слипается в амилоидные бляшки между клетками мозга - амилоидная теория утверждает, что эти бляшки повреждают и в конечном итоге убивают клетки мозга. Амилоидные бляшки, по-видимому, развиваются на ранних стадиях болезни, в то время как тау-связки, как правило, появляются на более поздних стадиях заболевания. Большая часть исследований, проводившихся с целью найти лечение болезни Альцгеймера, была направлена на удаление амилоидных бляшек.
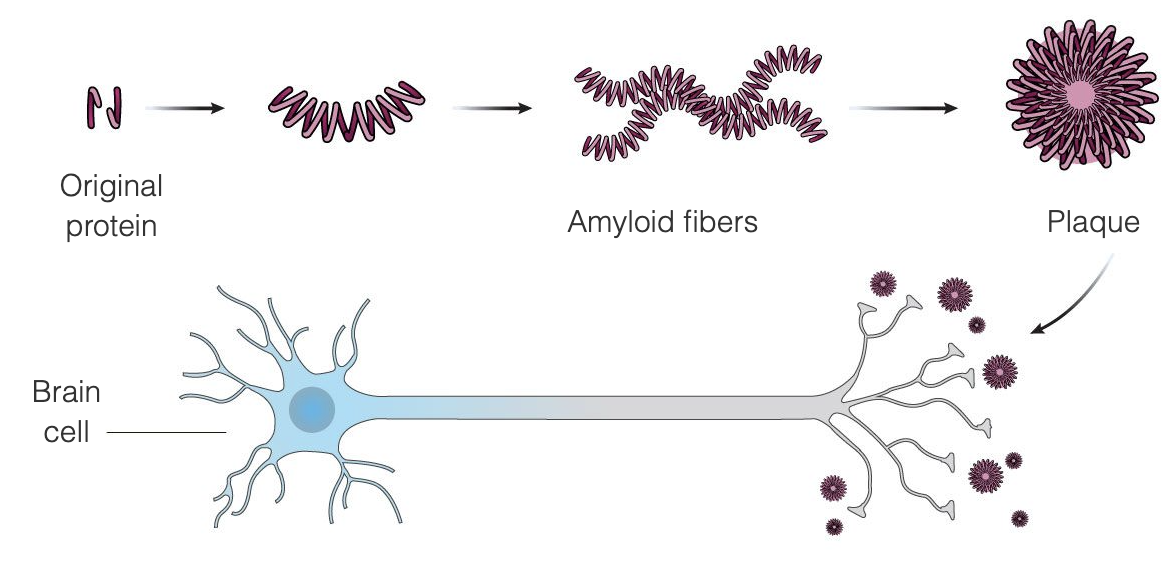
Препарат Aduhelm предназначен для лечения болезни Альцгеймера на самых ранних стадиях заболевания, связываясь с амилоидными бляшками, что заставляет иммунную систему уничтожать бляшки, воспринимая их как инородного захватчика. Предполагается, что после удаления бляшек клетки мозга перестанут умирать и когнитивные функции перестанут ухудшаться. Aduhelm использует этот механизм для замедления прогрессирования заболевания, особенно для пациентов на ранних стадиях болезни Альцгеймера. Aduhelm не обращает вспять уже нанесенный ущерб.
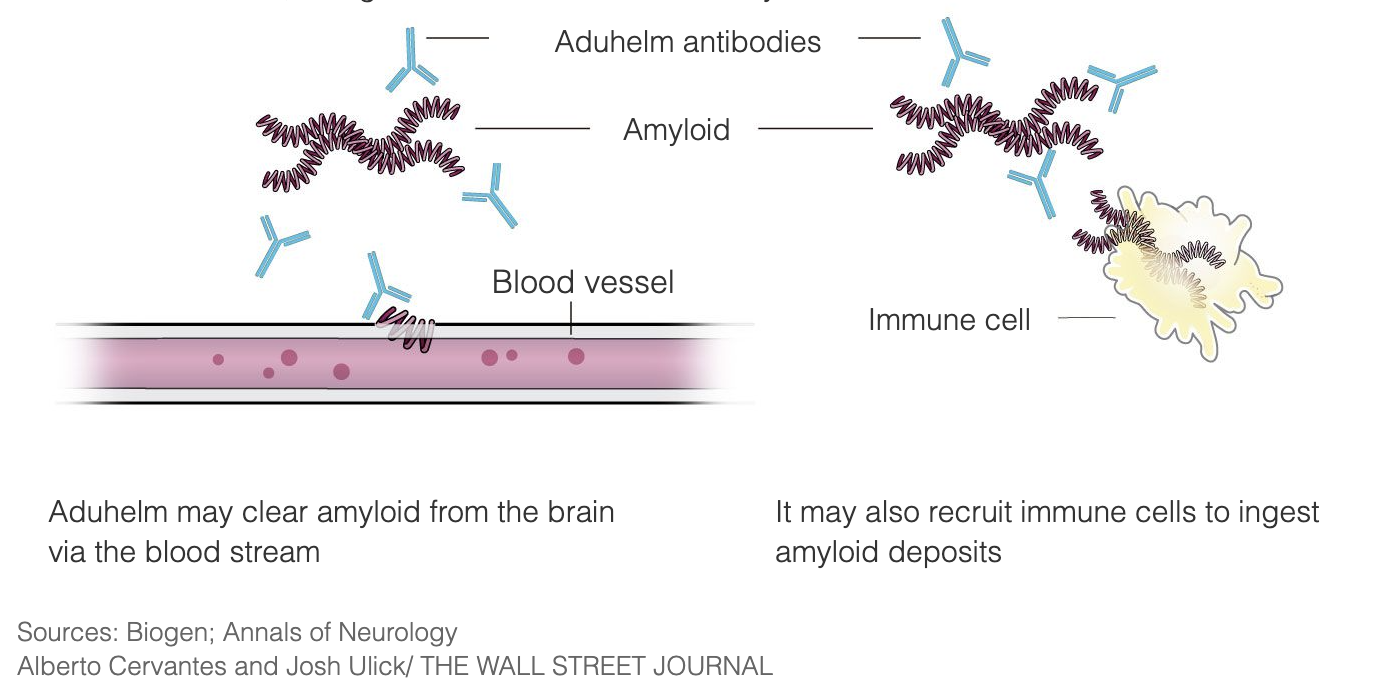
Амилоидные бляшки являются мишенью для исследований и разработки лекарств от болезни Альцгеймера уже 3 десятилетия, и Aduhelm - один из тех препаратов, которые исследовались на протяжении многих лет.
"Церковь Святой Амилоиды"
Ученые пока не пришли к единому мнению о том, что вызывает болезнь Альзеймера, но у них есть определенные теории. Одна из них называется "амилоидная гипотеза", и препарат Aduhelm был разработан на основе предположения, что эта теория верна.
Амилоидная гипотеза утверждает, что амилоидные бляшки, образующиеся между клетками мозга, вызывают гибель клеток, что приводит к снижению когнитивных способностей. Это давняя теория, которая никогда не была общепризнанной, а неудачи клинических испытаний, направленных на борьбу с амилоидными бляшками, еще больше укрепили ее критиков. Некоторые называют группу сторонников этой теории "церковью святого амилоида" из-за их нежелания, граничащего с отказом, рассматривать альтернативные теории.
Даже нормальная функция бета-амилоида в мозге оспаривается исследователями, поскольку они не согласны с тем, какую роль он естественным образом играет в организме человека или является маркером болезни Альцгеймера.
Распространенным контраргументом против амилоидной гипотезы является тот факт, что бляшки обнаруживаются в мозге многих пожилых людей с нормальными познаниями. Интересно, что некоторые посмертные исследования людей старше 90 лет с необыкновенной памятью выявили в их мозге амилоидные бляшки разной степени - у некоторых из них плотность была настолько высокой, что они напоминали самые тяжелые случаи болезни Альцгеймера, а также у них было гораздо больше нейронов, чем у людей, умерших с болезнью Альцгеймера.
Некоторые исследователи считают, что бета-амилоид может играть защитную роль.
Джордж Перри, нейробиолог из Техасского университета в Сан-Антонио, предполагает, что "накопление бета-амилоида и тау на самом деле является защитной реакцией на возрастное метаболическое давление в клетке" и особенно полезно для снижения окислительного стресса в мозге (окислительный стресс увеличивается с возрастом, что повреждает клетки).
В ряде исследований изучались другие потенциальные причины болезни Альцгеймера. Одно из таких исследований было проведено учеными из Медицинской школы Икан при Маунт-Синай в Нью-Йорке, которые обнаружили, что два штамма вируса под названием HHV (входящего в семейство герпесвирусов) обнаруживаются в большем количестве в мозге людей с болезнью Альцгеймера. Хотя нет уверенности в том, что именно эти два вируса вызывают болезнь (более вероятно, что причиной является сочетание вируса и определенного варианта гена, называемого APOE), данные свидетельствуют о том, что инфекция повышает риск развития болезни Альцгеймера, а у людей, получающих противовирусные препараты, вероятность развития болезни Альцгеймера в десять раз ниже.
Однако в поддержку амилоидной теории говорят данные генетических исследований, которые связывают проблемы с генами амилоида с развитием ранней стадии болезни Альцгеймера (у людей в возрасте от 30 до 65 лет). Синдром Дауна считается фактором риска, поскольку исследователи обнаружили, что люди с синдромом Дауна имеют лишнюю копию хромосомы, содержащей ген, кодирующий белок амилоида, связанный с ранним развитием болезни Альцгеймера.
Другие генетические аномалии могут приводить к выработке более длинных вариантов бета-амилоида, которые легче образуют бляшки, или увеличивать выработку бета-амилоида и вызывать несколько редких случаев раннего начала болезни Альцгеймера. Несколько членов одной семьи могут нести эти генные мутации и повышать риск развития ранней стадии болезни Альцгеймера.
Сторонники амилоидной теории предполагают, что предыдущие испытания лекарств, направленных против амилоидных бляшек , были просто ошибочными. Например, исследование семагацестата, ингибитора выработки бета-амилоидных белков, привело к ухудшению когнитивных способностей участников исследования; кроме того, ученые отметили рост заболеваемости раком кожи среди участников. Возможно, это связано с тем, что семагацестат подавлял выработку не только бета-амилоида, но и других белков, некоторые из которых выполняют важные функции в организме человека.
Наиболее вероятное объяснение неудачи испытаний, направленных на амилоиды, заключается в том, что лекарства являются правильными, но применяются не в тот момент, когда болезнь Альцгеймера прогрессирует - они назначаются слишком поздно в процессе формирования амилоидных бляшек, который начинается за десятилетия до появления симптомов.
Майкл Мерфи, невролог из Университета Кентукки, отмечает, что "вероятно, у нас уже есть препарат, который мог бы лечить болезнь Альцгеймера, если бы мы давали его людям в возрасте 50 лет".
О причинах болезни Альцгеймера ведутся серьезные споры, и эксперты пока не пришли к единому мнению, но пациенты и исследователи поймали новый ветер благодаря результатам исследования адуканумаба в одном из клинических испытаний 3-й фазы, проводимых компанией Aduhelm.
Aduhelm в клинических испытаниях
Клинические испытания проходят в четыре этапа:
- Фаза 0: Лекарство тестируется в очень малых количествах на менее чем 15 участниках, чтобы убедиться, что оно не вредно и что испытания можно продолжать.
- Фаза 1: Лекарство тестируется на 20-80 участниках без сопутствующих заболеваний, чтобы убедиться в отсутствии серьезных побочных эффектов. По данным FDA, около 70 % лекарств переходят во вторую фазу.
- Фаза 2: лекарство тестируется на нескольких сотнях участников с заболеванием, для лечения которого оно предназначено, в течение нескольких месяцев или лет, чтобы собрать информацию о его эффективности и побочных эффектах. Около 33 % лекарств переходят в фазу 3.
- Фаза 3: Лекарство тестируется на 3000 участниках с заболеванием, для лечения которого оно предназначено, и может длиться несколько лет. Должна быть доказана безопасность и эффективность лекарства. 25-30% лекарств переходят в фазу 4.
- Фаза 4. Эта фаза охватывает тысячи участников в течение многих лет и проводится после того, как FDA одобрило лекарство. Его цель - собрать больше информации о его долгосрочной безопасности и эффективности.
Aduhelm в фазе 1
Компания Biogen провела несколько клинических исследований адуканумаба, начиная с трех исследований фазы 1 в 2011 году, в которых адуканумаб тестировался на здоровых добровольцах и пациентах с болезнью Альцгеймера в США и Японии, с использованием различных доз адуканумаба и плацебо. Некоторые пациенты принимали участие в исследовании более 3 лет.
В 2016 году компания Biogen опубликовала результаты клинического испытания фазы 1, в ходе которого участникам исследования с легкой формой болезни Альцгеймера в течение одного года проводились ежемесячные внутривенные инфузии адуканумаба. У участников, получавших адуканумаб, снизился уровень бета-амилоида в головном мозге и замедлилось снижение когнитивных способностей по официальному клиническому рейтингу деменции. Среди участников, получавших инфузии адуканумаба, исследователи Biogen также зафиксировали снижение побочных эффектов, таких как ARIA (аномалии визуализации, связанные с амилоидом, например, отек мозга или кровоизлияния в мозг). Компания Biogen сочла эти результаты достаточно обнадеживающими, чтобы перейти к фазе 2.
Aduhelm в фазе 2
Компания Biogen начала испытания фазы 2 в конце 2018 года и оценила безопасность продолжения приема адуканумаба, а также проверила уменьшение количества амилоидных бляшек и замедление снижения когнитивных способностей у участников с ранней стадией и симптоматической болезнью Альцгеймера.
Адуканумаб не достиг своей основной цели - замедления снижения когнитивных функций в течение 12 месяцев, но после повторного анализа данных, полученных за 18 месяцев исследования, положительный эффект был отмечен в одной из пяти доз - самой высокой дозе адуканумаба. Было показано, что самая высокая доза уменьшает количество амилоидных бляшек в мозге, а также положительно влияет на когнитивные функции.
Побочные эффекты, как и в Фазе 1, такие как ARIA (аномалии визуализации, связанные с амилоидом), наблюдались примерно у 10% всех участников, и менее чем у 15% участников, получавших самые высокие дозы адуканумаба.
"Результаты 18-месячного исследования BAN2401 впечатляют и обеспечивают важную поддержку гипотезе амилоида, - сказал Джефф Каммингс, директор-основатель Центра здоровья мозга Кливлендской клиники Лу Руво, в заявлении для Biospace.
Aduhelm в третьей фазе
После получения результатов исследования фазы 2 компания Biogen провела два исследования фазы 3 под названием Engage и Emerge, в которых приняли участие чуть менее 3300 человек с относительно легкой формой болезни Альцгеймера в Северной Америке, Австралии, Европе и Азии. Адуканумаб вводился один раз в месяц в низких и высоких дозах путем инъекции в кровоток и сравнивался с результатами участников, получавших плацебо.
В марте 2019 года компания Biogen прекратила два исследования фазы 3, сославшись на анализ бесперспективности, проведенный независимым комитетом по мониторингу данных, который пришел к выводу, что адуканумаб, похоже, не работает так, как предполагалось.
Это решение затронуло 3300 участников исследования. Протоколы участия в исследовании предполагали частые и длительные визиты, включавшие забор крови, МРТ, ПЭТ-сканирование, а иногда и спинномозговые пункции. Через семь месяцев после прекращения двух исследований компания Biogen объявила, что повторный анализ дополнительных данных показал, что в высоких дозах препарат , по-видимому, снижает когнитивные способности.
В пресс-релизе компании Biogen говорится, что дополнительные данные состоят из результатов подгруппы пациентов в исследовании фазы 3 Engage, которые получали высокую дозу адуканумаба и испытывали значительное снижение когнитивных и функциональных нарушений (память, ориентация, язык), а также преимущества в повседневной жизни (выполнение домашних дел, походы по магазинам, самостоятельное передвижение вне дома). Основываясь на этих результатах, компания Biogen подала заявку на получение регуляторного разрешения на адуканумаб в октябре 2019 года и получила его в начале июня 2021 года.
Хотя клинические испытания фазы 3 не были полностью убедительными в отношении преимуществ терапии в отношении познавательных и функциональных функций, FDA пришло к выводу, что испытания продемонстрировали, что адуканумаб, выпускаемый под торговым названием Aduhelm, может уменьшать количество амилоидных бляшек, что послужило основанием для принятия FDA решения об ускоренном одобрении.
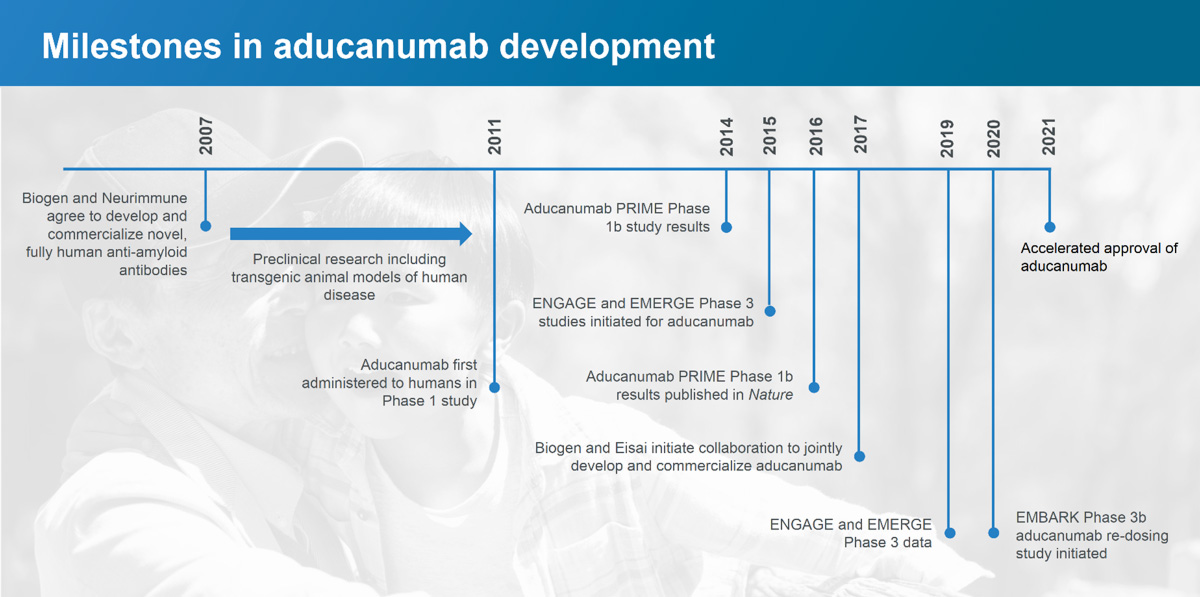
Участник испытания и журналист Фил Гутис написал для новостной платформы Being Patient: "Благодаря продольному ПЭТ-сканированию я узнал, что в моем мозге больше нет амилоида. Сканирование, проведенное около двух лет назад в рамках исследования Aging Brain Cohort в Центре памяти Пенна, подтвердило мои растущие предчувствия, что адуканумаб действительно помогает мне. Я начал чувствовать, что выхожу из постоянного умственного тумана... С другой стороны, воспоминания, которые я потерял, не вернулись".
Побочные эффекты и противопоказания препарата Aduhelm
Согласно руководству по приему лекарств компании Biogen, прежде чем принимать Aduhelm, пациенты должны проинформировать своих лечащих врачей обо всех своих заболеваниях, в том числе о том, если они имеются:
- беременны или планируют забеременеть
- кормят грудью или планируют кормить грудью
Пациенты должны сообщить своему лечащему врачу обо всех принимаемых ими лекарствах, включая рецептурные и безрецептурные препараты, витамины и травяные добавки.
Согласно справочнику лекарств компании Biogen, основным известным побочным эффектом препарата Aduhelm является ARIA (amyloid-related imaging abnormalities) - отек головного мозга и кровоизлияния в мозг. Другими побочными эффектами являются:
- серьезные аллергические реакции, такие как отек лица, губ, рта или языка, крапивница
- головные боли
- диарея
- спутанность сознания/делирий/измененный психический статус/дезориентация
- водопад
ARIA - это распространенный побочный эффект, который обычно не вызывает никаких симптомов, но может быть серьезным. Чаще всего он проявляется в виде временного отека мозга, который со временем обычно проходит сам по себе. В то же время удаление амилоида из мозга также удаляет амилоид из кровеносных сосудов, что может привести к образованию небольших пятен кровоизлияния в мозге или на его поверхности.
ARIA наблюдалась у 41% участников клинических испытаний, получавших адуканумаб, по сравнению с 10% участников, получавших плацебо.
Хотя у большинства людей с отеком участков мозга симптомы не проявляются, примерно у 30% людей могут быть легкие симптомы, такие как:
- путаница
- головные боли
- головокружение
- изменения зрения
- тошнота
Дэниел Гиббс, невролог на пенсии и многолетний участник клинических испытаний Aduhelm , поделился своим опытом лечения крайне редкого побочного эффекта ARIA:
"Прежде всего, я должен сказать, и это догма, которая в основном верна, что [ARIA] обычно доброкачественные. Большинство людей не знают, что у них это заболевание. [ОРИ] обнаруживаются только на МРТ, где есть небольшие участки припухлости или крошечные участки отложения железа в результате кровотечения. Если у людей и есть симптомы, то они обычно слабые. Чаще всего это головная боль, иногда спутанность сознания.
Но почти всегда, даже при симптомах ARIA, если вы прекратите прием препарата, они пройдут через несколько месяцев. Препарат можно безопасно возобновить. Было очень мало случаев, по крайней мере тех, которые обсуждались производителем препарата Biogen, [катастрофических или серьезных ARIA, и мой случай относился к этой категории. [...]
У меня участились головные боли. Головные боли случаются у меня не так уж редко, поэтому я не придавал этому значения, но они стали немного чаще и, возможно, немного сильнее, но все равно снимались безрецептурными [лекарствами]. [...]
Затем за ночь или две до Рождества 2017 года у меня началась сильнейшая головная боль в моей жизни - такая, которую мы, неврологи, связываем с субарахноидальным кровоизлиянием, массивным кровотечением в мозг. Я измерил кровяное давление, и оно было очень высоким и оставалось высоким, так что я подумал, что у меня инсульт.
Жена отвезла меня в отделение неотложной помощи, и к тому времени, когда я добрался до нашей местной больницы, я уже не мог толком рассказать о себе. [...]
Но уже через несколько дней мне стало немного лучше. Головная боль прошла, но у меня по-прежнему были проблемы с чтением. В течение следующего месяца стало немного хуже. К тому времени МРТ показала, что это ARIA - и отек, и кровоизлияние по всему мозгу. Поскольку состояние увеличивалось, было решено, что его нужно лечить. Я получил пять доз стероидов в высокой дозировке, и это сразу же избавило меня от головной боли и спутанности сознания. Но потребовалось около шести месяцев, чтобы отек мозга полностью прошел".
В связи с этими редкими, но серьезными потенциальными побочными эффектами медицинские работники пациентов должны будут проводить магнитно-резонансную томографию (МРТ) до и во время лечения препаратом Aduhelm , чтобы проверить наличие ARIA.
Одобрение препарата Aduhelm (адуканумаб)
7 июня 2021 года FDA выдало ускоренное разрешение на применение препарата Aduhelm (адуканумаб) для лечения болезни Альцгеймера.
Ускоренное одобрение - это вид одобрения, которое может быть выдано лекарствам, показавшим положительный терапевтический эффект в ходе клинических испытаний, до того как будут представлены все убедительные доказательства. Ускоренное одобрение может быть получено только для лекарств, предназначенных для лечения серьезных заболеваний и удовлетворяющих неудовлетворенные медицинские потребности; последний препарат, одобренный для лечения болезни Альцгеймера, был одобрен более 18 лет назад.
Ускоренное одобрение выдается условно. FDA требует от производителя, компании Biogen, провести новое клиническое исследование, чтобы проверить клиническую пользу препарата. Если исследование не покажет пользу, FDA может отозвать одобрение препарата. У компании Biogen есть время до 2029 года, чтобы завершить еще одно клиническое исследование, подтверждающее пользу адуканумаба для пациентов с болезнью Альцгеймера; эксперты утверждают, что третье клиническое исследование, которое можно завершить за два года, было бы лучшим вариантом, чем ждать восемь лет, чтобы выяснить, работает ли лекарство, пока пациенты проходят дорогостоящее лечение и надеются на лучшее.
Медицинский спор с финансовым подтекстом
Решение FDA одобрить адуканумаб озадачило экспертов, которые утверждают, что доказательств того, что Aduhelm является эффективным средством лечения болезни Альцгеймера, недостаточно. Многие из них, включая независимую комиссию, рекомендовали FDA, что имеющиеся данные вызывают значительные сомнения в том, что адуканумаб может замедлить снижение когнитивных функций, и обсуждали, являются ли положительные результаты только одного из двух исследований фазы 3 достаточным основанием для одобрения FDA.
Вскоре после одобрения препарата трое ученых в знак протеста вышли из состава независимого комитета, который консультировал FDA по поводу лечения, сославшись на отсутствие убедительных доказательств. Они также раскритиковали решение FDA одобрить адуканумаб для всех, кто страдает болезнью Альцгеймера, несмотря на то, что исследование проводилось на ранней стадии болезни Альцгеймера, и принятие теории о том, что уменьшение амилоидных бляшек действительно замедлит развитие когнитивных симптомов (несмотря на разногласия в научном сообществе по поводу ее обоснованности).
Решение FDA одобрить адуканумаб на этих условиях может иметь несколько последствий.
- Другие препараты, воздействующие на амилоидные бляшки, такие как донанемаб компании Eli Lilly, могут быть одобрены быстрее, чем прогнозировалось ранее, что подстегнет интерес фармацевтических компаний к инвестированию в лекарства от болезни Альцгеймера или продолжению участия в существующих испытаниях.
- Решение Управления по контролю качества пищевых продуктов и лекарственных препаратов создало ощущение гибкости регулирования, что могло бы стимулировать другие биотехнологические компании к разработке лекарств для лечения редких заболеваний, - стремление, которое сошло на нет после длительной череды неудач в клинических испытаниях, особенно за 18 лет, прошедших между утверждениями лекарств от болезни Альцгеймера.
- Лекарство довольно дорогостоящее - 56 000 долларов в год, что означает возможное повышение тарифов на частное медицинское страхование, поскольку страховщики должны будут оплачивать его, а также увеличение нагрузки на налогоплательщиков в рамках программы Medicare (национальное медицинское страхование США). Некоторые говорят, что это может стать "разрушительным" для Medicare не только из-за базовой стоимости, но и потому, что лечение препаратом Aduhelm требует от пациентов более ранней диагностики с помощью спинномозговых пункций для выявления амилоида и постоянного мониторинга с помощью МРТ (среди прочего), что значительно увеличивает расходы и оказывает давление на медицинские системы.
Одобрение препарата также считается выгодным для компании Biogen: ее акции выросли более чем на 50%, а акции японского партнера Eisai Co поднялись на 56%. По прогнозам аналитиков, продажи Aduhelm могут составить около 10 миллиардов долларов, учитывая, что только в США насчитывается 6 миллионов человек с диагнозом "болезнь Альцгеймера". Этот препарат важен для роста компании Biogen, поскольку конкуренция негативно сказалась на продажах ее лекарств - Tecfidera от рассеянного склероза (РС) и Spinraza от спинальной мышечной атрофии (СМА).
Spinraza - еще один препарат в портфеле Biogen с высокой ценой: его стоимость составляет 750 000 долларов в первый год лечения и 375 000 долларов в последующие годы.
Не все критикуют решение FDA одобрить препарат Aduhelm
Поскольку болезнь Альцгеймера - прогрессирующее заболевание, пациенты нуждаются в лечении скорее раньше, чем позже. Новость о решении Управления по контролю за продуктами и лекарствами США дала многим новую надежду - либо на то, что лечение поможет им самим или их близким, либо на то, что оно подтолкнет другие компании к разработке других методов лечения болезни Альцгеймера.
Группы защиты прав пациентов активно добивались одобрения препарата, поскольку существует всего шесть других методов лечения этого изнурительного заболевания, которые устраняют симптомы лишь на несколько месяцев. В ноябре 2020 года консультативный комитет FDA проголосовал против одобрения препарата Aduhelm, что вызвало гнев, а затем и действия со стороны Ассоциации Альцгеймера, которая провела кампанию, чтобы выразить свою поддержку потенциала препарата и подчеркнуть необходимость надежды и прогресса.
В январе 2021 года Управление по контролю за продуктами и лекарствами США и группы пациентов провели встречу , на которой пациенты, лица, осуществляющие уход, врачи и защитники высказались в пользу лечения, утверждая, в частности, что пациенты не могут позволить себе больше ждать лечения.
Директор Управления по контролю за новыми лекарственными средствами Питер Стайн подтвердил на пресс-конференции, что мнение пациентов сыграло свою роль. По его словам, FDA "очень четко услышало от пациентов, что они готовы принять некоторую неопределенность, чтобы получить доступ к препарату, который может принести значительную пользу в предотвращении прогрессирования этого заболевания, которое, как мы все знаем, может иметь очень разрушительные последствия".
Патриция Каваццони, исполняющая обязанности директора Центра по оценке и исследованию лекарственных средств FDA, заявила на той же пресс-конференции, что "данные подтверждают, что пациенты и те, кто за ними ухаживает, имеют право выбора использовать этот препарат".
"Это одобрение FDA открывает новую эру в лечении и исследованиях болезни Альцгеймера", - сказала Мария Каррильо, доктор философии, главный научный сотрудник Ассоциации Альцгеймера. "История показывает, что одобрение первого препарата в новой категории оживляет отрасль, увеличивает инвестиции в новые методы лечения и стимулирует инновации".
Когда Aduhelm будет одобрен в Европе?
Болезнь Альцгеймера стремительно превращается в один из главных медицинских, экономических и социальных кризисов столетия, и ее трудно обнаружить на ранних стадиях, особенно учитывая нехватку специалистов в Европе, которые могут подтвердить диагноз. Только в Европе по состоянию на 2018 год 9,7 миллиона человек страдают от болезни Альцгеймера и других форм деменции; по прогнозам, к 2030 году число пациентов вырастет до 14 миллионов, что создаст острую потребность в эффективных методах лечения.
Препарат Aduhelm еще не был одобрен за пределами США. Компания Biogen подала заявку на проведение регуляторного обзора в Европейском союзе в октябре 2020 года, а также в Японии, Канаде, Австралии и Бразилии в конце 2020 года.
По данным Европейского агентства по лекарственным средствам (EMA), рассмотрение заявки на получение разрешения на продажу нового лекарственного средства обычно занимает около года, но меньше, если разработчик препарата получает ускоренную оценку.
В марте этого года производственный комплекс компании Biogen в Швейцарии стоимостью 2 миллиарда долларов получил лицензию на надлежащую производственную практику (GMP) от Швейцарского агентства по терапевтическим препаратам (Swissmedic). Biogen планирует получить разрешение FDA на производство Aduhelm на швейцарском предприятии в конце 2021 года и рассчитывает поставлять препарат более чем 1 миллиону пациентов в год.
Доступ к Aduhelm за пределами Соединенных Штатов
В настоящее время препарат Aduhelm одобрен Управлением по контролю качества пищевых продуктов и лекарственных препаратов США и доступен для жителей Соединенных Штатов Америки, но существуют правила, позволяющие импортировать лекарства в страны, где они в настоящее время не одобрены.
Пациенты с опасными для жизни или изнурительными заболеваниями имеют право на доступ, приобретение и импорт лекарств с помощью своих лечащих врачей.
Пациенты и их врачи могут сделать это на основе принципа сострадания или правил ввоза именных пациентов- юридического исключения из общего правила, согласно которому доступ к лекарству обычно возможен только после получения разрешения/одобрения на рынке (любую формулировку мы используем) в стране, где живет пациент. Это исключение позволяет пациентам законным, этичным и безопасным способом получить доступ к лекарствам, которые еще не одобрены в их стране.
Подробнее о "базе именных пациентов" читайте здесь (EMA) .
everyone.org стремится к тому, чтобы пациенты и их лечащие врачи имели доступ к любым лекарствам, доступным во всем мире, для наилучшего лечения. Если вы находитесь за пределами Соединенных Штатов, мы на 100% соблюдаем правила, действующие в вашей стране. Если вы хотите прочитать более подробную информацию, получить доступ к лекарству или связаться с нашей службой поддержки , вы можете сделать это здесь.
Сколько стоит Aduhelm ?
Компания Biogen объявила, что стоимость Aduhelm в поддерживающей дозе (10 мг/кг) для среднего пациента составит 56 000 долларов в год. Это без учета анализов, которые пациенты должны сдать до начала лечения и во время него.
Компания Biogen подверглась критике в связи с высокой стоимостью препарата в год.
Некоммерческий Институт клинико-экономического анализа (ICER), анализирующий цены на лекарства, указал, что справедливая годовая цена составит от 2500 до 8300 долларов США на пациента в год. В заявлении ICER говорится, что одобрение FDA не защищает пациентов, и Biogen может получать более 50 миллиардов долларов в год "даже в ожидании доказательств, подтверждающих, что пациенты получают реальную пользу от лечения".
Генеральный директор компании Biogen Мишель Вунатсос ответил на критику, заявив, что цена препарата оправдана той пользой, которую он принесет пациентам и обществу, менее отягощенному болезнью Альцгеймера, и что цена является отражением "двух десятилетий отсутствия инноваций". "Пришловремя инвестировать в лечение", - добавил он.
На сайте everyone.org мы не можем повлиять на цену, установленную компанией Biogen. Мы можем помочь пациентам получить доступ к Aduhelm по следующим ценам:
- 1 958,58 евро за один флакон 170 мг/1,7 мл (100 мг/мл)
- 3 046,68 евро за один флакон 300 мг/3 мл (100 мг/мл)
Для получения дополнительной информации сделайте запрос здесь.
Новые методы лечения болезни Альцгеймера
Исследование, опубликованное в мае 2021 года, показывает, что в настоящее время в клинических испытаниях находятся 126 препаратовдля лечения болезни Альцгеймера. 82,5 % из них направлены на модификацию болезни, 10,3 % - на улучшение когнитивных функций, а 7,1 % - на облегчение нейропсихиатрических симптомов.
- Фаза 3 исследований: 28 методов лечения (включая адуканумаб)
- Испытания фазы 2: 74 процедуры
- Испытания фазы 1: 24 процедуры
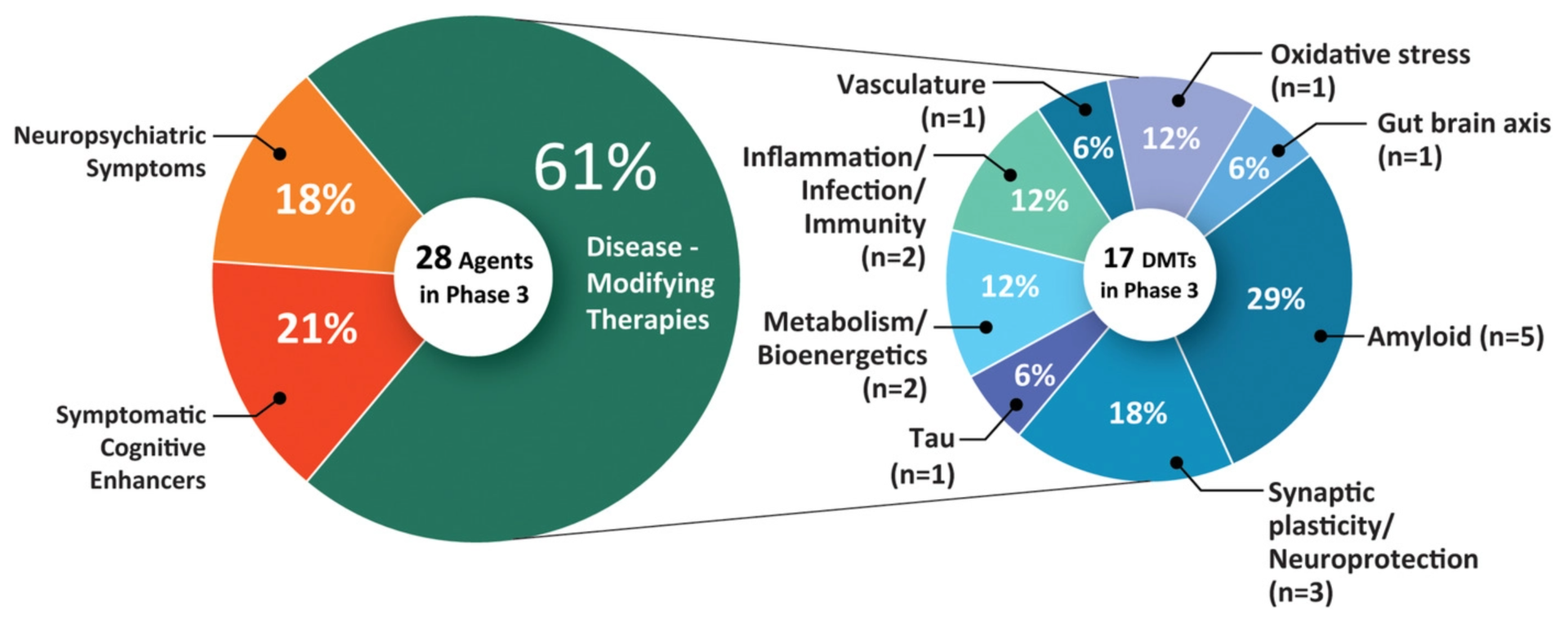
Лекарства, проходящие испытания фазы 3, скорее всего, будут одобрены в следующем году.
Леканемаб
Моноклональное антитело леканемаб, действующее аналогично адуканумабу (запускающее иммунную систему для удаления бета-амилоидных бляшек), согласно опубликованным отчетам, показывает многообещающие результаты и уже перешло к фазе 3 клинических испытаний.
Гантенерумаб
Гантенерумаб связывается с бета-амилоидом, особенно с бляшками бета-амилоида по сравнению с отдельными бета-амилоидами, которые циркулируют в крови. Считается, что он растворяет амилоидные бляшки и удаляет бета-амилоид, стимулируя фагоцитоз - процесс, в ходе которого клетка захватывает определенную молекулу внутрь себя и переваривает ее. Предыдущие клинические исследования гантенерумаба показали, что он уменьшает количество бета-амилоидных бляшек у людей с более распространенной формой болезни Альцгеймера, которая не вызвана непосредственно генными мутациями. Препарат продолжает изучаться в двух крупных глобальных исследованиях III фазы.
Соланезумаб
Соланезумаб - это антитело, которое призвано "очищать" бета-амилоид из крови и спинномозговой жидкости, тем самым предотвращая образование бляшек. Преимущества препарата были отмечены у участников, принимавших участие в испытаниях в течение всех трех с половиной лет, и в меньшей степени у тех, кто присоединился к ним позже, так что о его действии еще предстоит узнать.
Донанемаб
Донанемаб представляется еще одним перспективным препаратом для лечения болезни Альцгеймера. Его тестирует компания Eli Lilly and Company, которая планирует набрать 1500 участников в крупное исследование, чтобы подтвердить результаты более мелкого исследования; предыдущее исследование длилось 76 недель и включало 257 пациентов, и, согласно отчетам, показало, что донанемаб значительно замедлил прогрессирование болезни Альцгеймера.
Другие
Саракатиниб - это экспериментальный препарат, который действует как ингибитор белка под названием Fyn kinase, способствующего образованию бета-амилоидных бляшек. Исследование, проведенное на мышах, показало, что саракатиниб, ингибируя киназу Fyn, эффективно обращает вспять потерю памяти у мышей. Ингибирование киназы Fyn может предотвратить или задержать прогрессирование заболевания.
Исследователи из Института биологических исследований Salk в Калифорнии изучают химическое вещество под названием фисетин и разработали его версию под названием CMS121, которая, как они обнаружили, эффективно замедляет потерю клеток мозга. Прежде чем лекарство будет готово к утверждению, необходимо провести дополнительные исследования.
По поводу недавнего одобрения препарата AduhelmМария Каррильо, главный научный сотрудник группы по защите прав пациентов Ассоциации Альцгеймера в Чикаго (США), сказала в своем заявлении для Nature: "Мы надеемся, что это начало - как для этого препарата, так и для более эффективных методов лечения болезни Альцгеймера".
"Все, чем мы на самом деле являемся, - это наши мысли и наш мозг". - Сэнди, бывший стоматолог, ассистент профессора и пациент с болезнью Альцгеймера.
На сайте everyone.org мы убеждены, что наука двигает человечество вперед, улучшает и даже спасает жизни. Болезнь Альцгеймера ставит под угрозу качество жизни многих людей. Мы призываем ученых, стремящихся найти (часть) решения, не останавливаться на достигнутом и с нетерпением ждем, когда разрабатываемые методы лечения, демонстрирующие многообещающие результаты, будут одобрены и станут доступными для пациентов с болезнью Альцгеймера во всем мире в течение ближайших 3 лет.