Одобрение Erdafitinib в EMA: Что мы имеем спустя пять лет после первого глобального одобрения
Последнее обновление: 19 августа 2024 г.

Вы можете легально получить доступ к новым лекарствам, даже если они не одобрены в вашей стране.
Узнайте, какСамые высокие показатели заболеваемости раком мочевого пузыря в мире наблюдаются в Европе 1. Поскольку ожидается, что только 8 % пациентов с поздней диагностикой проживут более пяти лет, потребность в инновационных методах лечения является насущной 6. В этом контексте ускоренное одобрение препарата Balversa Управлением по контролю качества пищевых продуктов и лекарственных средств США в 2019 году стало позитивной новостью и знаком надежды для пациентов с раком мочевого пузыря.
К сожалению, спустя 5 лет препарат Balversa erdafitinib) все еще недоступен для пациентов за пределами США.
Если вы живете в Европе или Великобритании, вот все, что вам нужно знать о сроках одобрения erdafitinib EMA и MHRA. В том числе о том, как получить препарат до того, как он станет доступен на местном рынке.
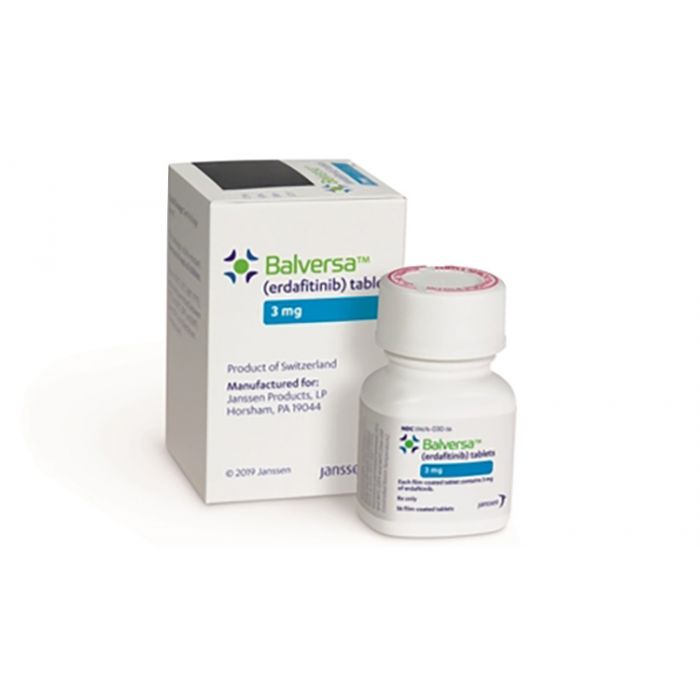
Для чего предназначен Balversaerdafitinib)?
Balversa - это рецептурный препарат для взрослых, страдающих раком мочевого пузыря (уротелиальным раком), который распространился или не может быть удален хирургическим путем. Лекарство предназначено для пациентов с аномальным геном FGFR, у которых по крайней мере один раунд системной терапии не дал результатов или прекратил действовать.
Balversa erdafitinib) не подходит для пациентов, которые имеют право на терапию ингибиторами PD-1 или PD-L1 и не получали ее ранее 2.
Каков процент успеха препарата Balversa?
Согласно результатам клинических исследований Balversaerdafitinib), это показатель успешности:
- У 30,1% пациентов, получавших erdafitinib , опухоль частично уменьшилась, по сравнению с 7,7% пациентов, получавших химиотерапию;
- У 5,1% пациентов, получавших erdafitinib , опухоль исчезла полностью, по сравнению с 0,8% пациентов, получавших химиотерапию;
- Медиана общей выживаемости при использовании erdafitinib составила 12,1 месяца против 7,8 месяца при химиотерапии 3.
Каково время ответа на erdafitinib?
Согласно данным клинических исследований, среднее время ответа на erdafitinib составило 1,4 месяца 4.
Как долго вы принимаете Balversa ?
Вы можете принимать Balversa erdafitinib) постоянно, до прогрессирования опухоли или появления неприемлемой токсичности 5. Ваш лечащий врач будет внимательно наблюдать за вами. Он лучше всего знает, следует ли приостановить или прекратить лечение в вашем случае.
Одобрена ли Balversa erdafitinib) EMA?
По состоянию на март 2024 года - еще нет. EMA приняло заявку на получение разрешения на маркетинг препарата Balversa в сентябре 2023 года. Заявка находится на рассмотрении, которое может занять до 210 дней, не считая перерывов на запрос дополнительной информации у производителя.
В реальности, если все пойдет хорошо, препарат Balversa erdafitinib) может быть одобрен EMA примерно в середине 2024 года.
Когда erdafitinib будет доступен в Европе?
К сожалению, одобрение EMA не означает автоматического появления препарата на рынке. Если erdafitinib получит положительную рекомендацию CHMP в середине 2024 года, потребуется еще 67 дней, чтобы одобрение EMA стало официальным. После этого каждая страна-член ЕС начнет свои собственные процедуры, чтобы сделать лекарство доступным на своем рынке. Длительность этих процедур сильно различается в разных странах - от 100 дней в Германии до 964 дней в Румынии 6.
Поэтому, в зависимости от того, где вы находитесь в Европе, erdafitinib может быть доступен для вас до конца 2024 года, а может быть, вам придется подождать еще пару лет.
Имеет ли Balversa разрешение Великобритании?
В настоящее время нет активной заявки на получение разрешения на маркетинг Balversaerdafitinib) в Великобритании. После подачи заявки на ее утверждение уходит примерно столько же времени, сколько и на утверждение EMA - 210 дней. После одобрения MHRA erdafitinib должен пройти проверку NICE, которая примет решение о его включении в список препаратов NHS. В случае положительного заключения NICE препарат должен появиться на рынке Великобритании в течение 3 месяцев.
Учитывая это, маловероятно, что Balversaerdafitinib) появится в продаже в Великобритании в ближайшее время.
Способы безопасного получения erdafitinib до его одобрения EMA и MHRA
Если вы больны раком мочевого пузыря, ждать больше года, чтобы получить доступ к препарату Balversa , возможно, не стоит. Хорошая новость заключается в том, что вам не придется ждать.
Существует два варианта получения эдафитиниба до его утверждения в Европе и Великобритании: участие в клинических испытаниях или приобретение препарата Balversa в качестве индивидуального пациента.
Присоединяйтесь к клиническим испытаниям erdafitinib
Чтобы получить быстрый доступ к Balversa erdafitinib), вы можете попробовать присоединиться к текущему клиническому исследованию. Найти такое исследование не всегда просто, но при правильном руководстве со стороны вашего лечащего врача это можно сделать. Чтобы принять участие в клиническом исследовании, вы должны соответствовать критериям отбора. Кроме того, вы должны знать, что вас могут включить в группу плацебо, а не в группу рабочих ингредиентов.
Вот несколько мест, где можно начать поиск текущих клинических испытаний erdafitinib :
- ClinicalTrials.gov: Это база данных со всеми клиническими исследованиями в США. Однако некоторые из них открыты и для иностранных участников. На данный момент существует множество исследований с участием Balversa, которые набирают участников - в том числе в Испании, Японии и Канаде.
- EUClinicaltrials.eu: Эта база данных содержит все клинические исследования в Европейском союзе. В настоящее время она содержит ограниченную информацию об исследованиях, начатых до 31 января 2022 года. Для этих исследований вы можете обратиться к Регистру клинических исследований ЕС.
- myTomorrows и FindMeCure: обе организации помогают пациентам найти варианты лечения в клинических испытаниях.
Купить Balversaerdafitinib) в качестве именного пациента
В большинстве стран пациентам разрешено покупать и импортировать лекарства, которые могут улучшить их жизнь или устранить угрожающие жизни состояния. Особенно если эти лекарства еще не одобрены или не доступны на местном рынке.
Если вы хотите получить доступ к erdafitinib до его одобрения MHRA или EMA, это может быть самым быстрым вариантом для вас и вашего врача.
Постановление, которое делает это возможным, известно как Положение о ввозе именных пациентов. Согласно этому положению, пациенты могут импортировать лекарство, которое еще не одобрено или не доступно в их стране, если:
- она утверждена в другом месте;
- у него нет местных альтернатив, и
- это для личного пользования.
Для этого требуется рецепт от лечащего врача пациента. Врач берет на себя ответственность за лечение. В разных странах требования к документации могут отличаться.
Хотите воспользоваться положением о ввозе именных пациентов, чтобы получить erdafitinib до его утверждения в Европе или Великобритании? Сначала вам необходимо проконсультироваться с лечащим врачом и получить соответствующий рецепт.
У вас уже есть рецепт? Поделитесь им с нашей командой на сайте Everyone.org - мы поможем вам купить erdafitinib немедленно.
Ссылки:
- Глобальное, региональное и национальное бремя рака мочевого пузыря и связанных с ним факторов риска в 204 странах и территориях, 1990-2019 годы: систематический анализ для исследования Global Burden of Disease study 2019, BMJ Global Health, Accessed 05 March 2024.
- Домашняя страница | BALVERSA® (erdafitinib), Accessed 5 March 2024.
- Как проводилось исследование препарата BALVERSA®? | BALVERSA® (erdafitinib). Balversa.com, Accessed 5 March 2024.
- Подходы к лечению уротелиальной карциномы с FGFR-изменением: таргетная терапия и иммунотерапия. NCBI, 22 августа 2023 г.
- Способ применения и дозы | BALVERSA® (erdafitinib) HCP. Balversa.com, Accessed 5 March 2024.
- Показатели выживаемости при раке мочевого пузыря. Американское онкологическое общество, доступ 5 марта 2024 года.